Les caractéristiques du produit
EBVALLO® est la première et la seule immunothérapie allogénique à lymphocytes T actuellement disponible à la demande autorisée pour le traitement d’une maladie lymphoproliférative post-transplantation et positive au virus d’Epstein-Barr récidivante ou réfractaire (LPT EBV+)
Lymphocytes T cytotoxiques spécifiques du virus Epstein-Barr
Allogénique :
Étendu aux donneurs tiers
Non modifiées
génétiquement
Compatibilité HLA
À la demande,
conserver dans une biobanque
EBV+ : positif à l’EBV ; HLA : antigènes des leucocytes humains ; LPT : maladie lymphoproliférative post-transplantation ; R/R : récidivantes ou réfractaires ; TOS : transplantation d’organe solide.
Réf. : RCP EBVALLO® : Ebvallo, INN – Tabelecleucel
Son mécanisme d’action
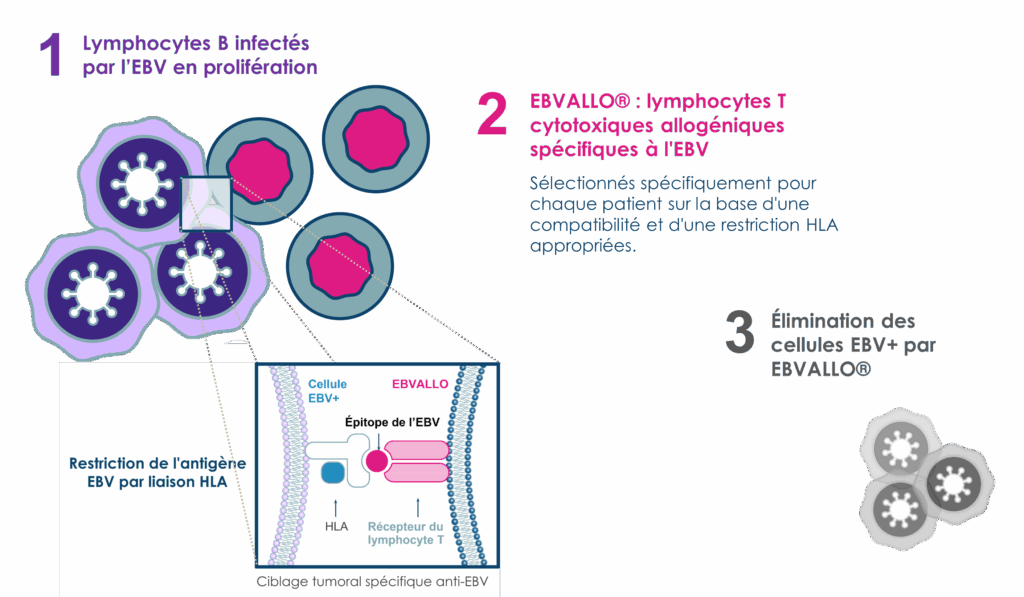
EBV : virus Epstein Barr ; EBV+ : positif à l’EBV ; HLA : antigène des leucocytes humains
Réf. : RCP EBVALLO® : Ebvallo, INN – Tabelecleucel
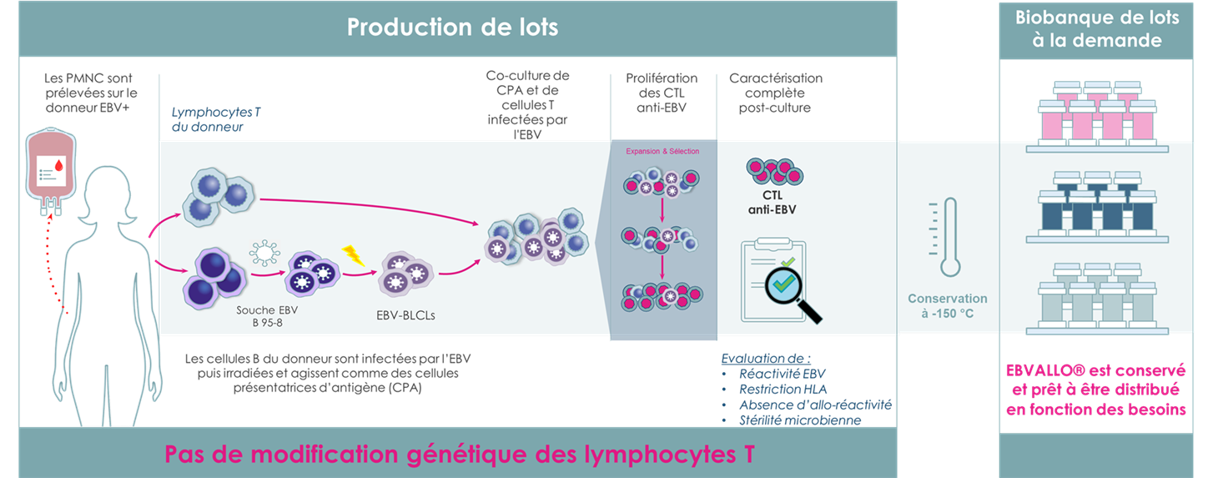
Production
EBVALLO® est fabriqué à partir de donneurs EBV+ sains présentant différents profils HLA afin de produire divers lots caractérisés par une cytotoxicité et une restriction HLA spécifique à l’EBV2
Identifiant ClinicalTrials.gov : NCT03394365
CPA : cellule présentatrice d’antigène ; CTL : souches de lymphocytes T cytotoxiques ; EBV : virus Epstein Barr ; EBV+ : positif à l’EBV ; HLA : antigènes des leucocytes humains ; PMNC : cellule mononucléaire périphérique.
Réf. : RCP EBVALLO® : Ebvallo, INN – Tabelecleucel
Cycle de traitement et algorithme associé
Chaque cycle d’EBVALLO® dure environ 35 jours – le nombre de cycles d’EBVALLO® nécessaires dépend de la réponse du patient3.
*Une RC à la fin d’un cycle suivie d’une RP ou autre réponse au cours d’un quelconque cycle ultérieur est considérée comme MP.
RC, réponse complète ; RP, réponse partielle ; MS, maladie stable ; RI, réponse indéterminée ; MP, maladie en progression.
1. RCP EBVALLO® : Ebvallo, INN – Tabelecleucel
3. NCT03394365. Disponible sur : https://clinicaltrials.gov/ct2/show/NCT03394365